Lo anterior
es especialmente importante para las operaciones de separación de líquidos por
destilación, ya que cuando se alcanza la composición del azeótropo de la mezcla
que se está separando, la separación se hace imposible por medio de la
destilación normal ya que la composición en el líquido es igual a la del vapor.
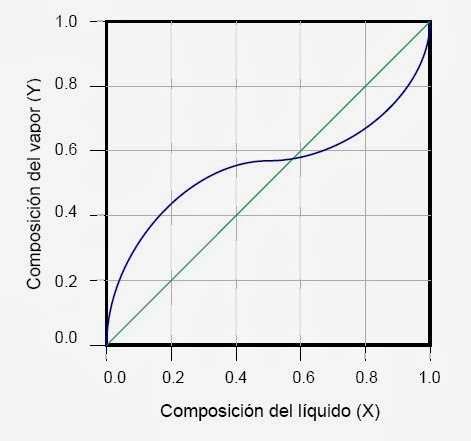
Para lograr separar las mezclas azeotrópicas por destilación son necesarias
operaciones adicionales que permitan romper el azeótropo.
Cuando una
mezcla azeotrópica tiene un punto de ebullición menor al de alguno de sus
componentes o todos, se denomina “azeótropo positivo” o también “azeótropo de
punto de ebullición mínima”. Este es el caso de la mezcla de etanol y agua.
Cuando una
mezcla azeotrópica tiene un punto de ebullición mayor a la de alguno de sus
componentes o todos, se denomina “azeótropo negativo” o también “azeótropo de
punto de ebullición máxima”. Un ejemplo de este tipo de azeótropo es la mezcla
entre cloroformo y acetona.
El origen
de la palabra azeótropo proviene de los vocablos griegos a (que significa “sin”),
zein (que significa “hervir”) y trope (que significa “cambio”) por lo que el
significado es “hervir sin cambio”, refiriéndose a una mezcla que hierve sin
cambio en la temperatura de ebullición ni en su composición.



Buen artículo.
ResponderEliminar